近日,我院邹懿教授课题组在催化领域国际著名期刊ACS Catalysis (ACS Catal., IF:12.35)在线发表了题为“Divergent Biosynthesis of Fungal Dioxafenestrane Sesquiterpenes by the Cooperation of Distinctive Baeyer-Villiger Monooxygenases and α-Ketoglutarate-Dependent Dioxygenases” (ACS Catal. 2021, 11, 948-957, DOI: 10.1021/acscatal.0c05319)的研究性论文。
天然药物的手性高效合成与衍生主要涉及药效官能团的理性设计与修饰,如何发现并开发具有高效催化性能的新型生物酶,并利用其对天然药物的惰性碳骨架进行立体选择性和位置选择性的精准编辑是天然药物酶学合成与生物催化研究的热点和难点。针对这一重要的科学问题,近几年来,邹懿教授课题组以真菌来源的具有显著抗虫活性和独特[5.5.5.6]-氧化型窗烷环倍半萜骨架为研究对象,对其骨架的合成机制与氧化后修饰进行了系统研究。
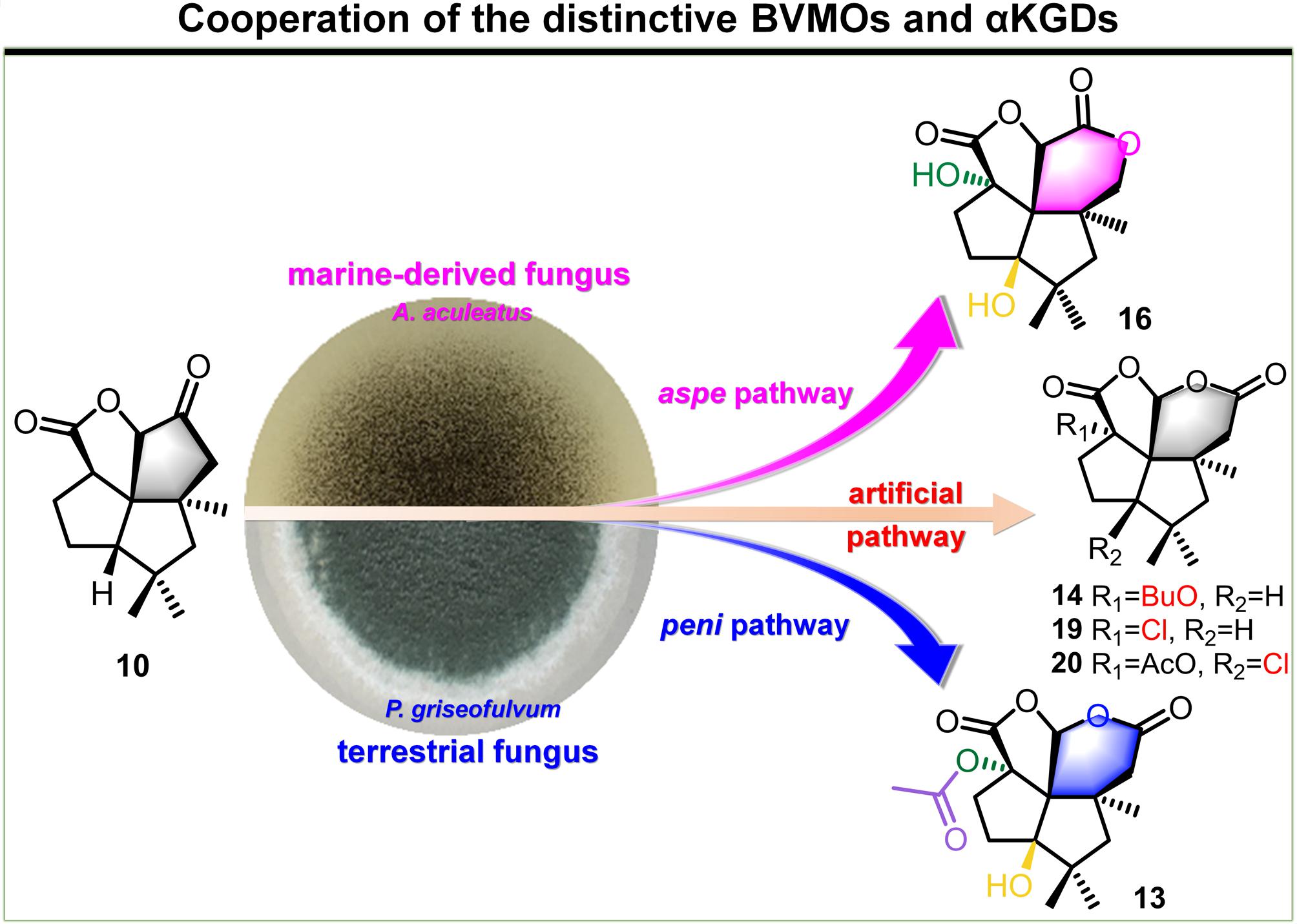
该课题组,在前期关于[5.5.5.6]-氧化型窗烷环倍半萜骨架酶学合成(Angew. Chem. Int. Ed. 2019, 58, 6569-6573)的研究基础上,采用基于序列网络分析的基因组挖掘策略,通过异源生物合成、化学喂养、基因敲除、酶法合成结合代谢工程改造等多学科交叉方法和策略,(1)在海洋真菌Aspergillus aculeatus的基因组中发现了asperaculin类窗烷环倍半萜生物合成基因簇,并在模式菌株构巢曲霉中异源重构了其完整生物合成途径。发现其与陆生真菌来源的penifulvin类窗烷环倍半萜在合成途径(peni和aspe)上共用同一前体,但在药效官能团δ-内酯环的形成过程中,分别由处于不同进化分支的Baeyer-Villiger氧化酶(PeniC和AspeB)催化不同位置选择性的插氧反应。其中AspeB是来自于海洋真菌的全新Baeyer-Villiger氧化酶;(2)在peni和aspe途径中发现具有底物宽泛性的α-KG依赖的双加氧酶(a-KGDs)AspeC/D和PeniD/F能高效地对氧化型窗烷环倍半萜骨架的惰性C-H键进行位置选择性和立体选择性的氧化反应,生成窗烷环倍半萜的氧化衍生物库;(3)通过对a-KGDs进行理性设计,采用定点突变技术,将a-KGD转化为卤代酶,创造性地在氧化型窗烷环倍半萜惰性碳骨架上引入了氯代修饰,从而极大地扩展了窗烷环倍半萜类化合物的结构多样性与复杂性。
该研究为不同环境来源天然产物的发散生物合成策略与生物酶功能进化关系提供了良好的研究范例,发现和开发的众多新颖氧化酶不但极大地扩充了天然药物合成生物学酶催化元件库,而且为今后通过组合生物合成或化学酶法合成等策略创造结构更复杂、生物活性更显著的萜类人工产物奠定了坚实的研究基础。
西南大学为该论文成果的唯一完成单位,博士后魏茜为论文第一作者,邹懿教授为通讯作者。该项研究得到了国家重点研发计划合成生物学重点专项,国家自然科学基金委面上项目、重庆市杰出青年基金项目、西南大学生物学“双一流”建设项目以及“聚贤工程”人才启动项目等基金资助。
邹懿教授自2017年7月通过高层次人才引进到药学院工作以来,以西南大学为唯一或第一完成单位,作为通讯作者,已陆续在J. Am. Chem. Soc. (IF:14.612),Angew. Chem. Int. Ed. (IF:12.959),ACS Catal. (IF:12.35),Org. Lett. (IF:6.091)和Acta. Pharm. Sin. B. (IF:7.097) 等国际著名期刊上发表高水平研究成果,在微生物来源的天然药物生物合成、酶学催化以及合成生物学领域取得了一系列重要进展,形成了鲜明的“化学-生物学-药学”交叉研究特色。