近日,学院邹懿教授课题组在国际知名期刊《Nature Communications》(《自然-通讯》)在线发表了题为“Unexpected assembly machinery for 4(3H)-quinazolinone scaffold synthesis”(DOI:10.1038/s41467-022-34340-3)的研究论文,系统揭示了药物优效骨架4(3H)-喹唑啉酮的全新酶学合成机制。
4(3H)-喹唑啉酮作为重要的药效骨架,其广泛存在于200多个天然生物碱和大量上市药物中。由于4(3H)-喹唑啉酮的广泛应用,合成化学家开发了一系列合成该骨架及其衍生物的方法。但是,4(3H)-喹唑啉酮骨架的天然酶学合成机制,之前仅在真菌fumiquinazoline类家族多肽生物碱中得以研究。
真菌来源的Chrysogine(1)作为最简单4(3H)-喹唑啉酮类天然产物,尽管其生物合成基因簇之前已在产黄青霉菌(P. chrysogenum)和禾谷镰刀菌(F. graminearum)中被相继鉴定,但是,关于该化合物详细的生物合成步骤和基因簇中各个酶的催化功能却未得到深入阐明。特别是双模块非核糖体多肽合成酶ChyA的功能与催化机制;结构中N-3位氮的来源和组装机制以及后续4(3H)-喹唑啉酮骨架的形成方式等重要科学问题亟需解决。
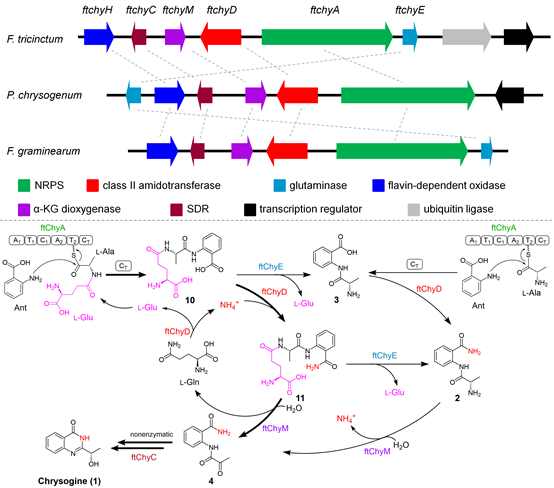
针对上述科学问题,邹懿教授课题组采用基因组挖掘方法,在三线镰刀菌(F. tricinctum)中鉴定了1的合成基因簇ftchy,并通过异源生物合成,化合物体内喂养,酶功能体外生化表征,同位素标记底物喂养和活性位点突变等方法和策略,深入揭示了1中4(3H)-喹唑啉酮骨架的全新酶学组装机制,主要包括以下几点:(1)双模块非核糖体多肽合成酶ftChyA罕见地催化线性三肽10的形成,其结构中存在稀有的l-谷氨酸的γ-COOH和l-丙氨酸的α-NH2形成的酰胺键;(2)ftChyA中独特的末端缩合结构域ftChyA-CT催化线下游离的邻氨基苯甲酸Ant进攻线上T2-硫酯中间体,从而释放形成三肽化合物10或二肽化合物3;(3)4(3H)-喹唑啉酮的N-3来源于无机铵根离子或l-谷氨酰胺的酰胺;(4)α-酮戊二酸依赖的双氧化酶(ftChyM)催化三肽11的C-N键断裂形成二肽4,并最终自发环化生成4(3H)-喹唑啉酮骨架。
本课题的研究结果,揭示了真菌非核糖体多肽独特的释放和后修饰机制,阐明了4(3H)-喹唑啉酮骨架的全新酶学合成机制,推动了4(3H)-喹唑啉酮类生物碱的生物合成进展,为该药物优效骨架的合成生物创制提供了新的合成逻辑和生物酶催化元件。
西南大学为该论文成果的唯一完成单位,药学院博士后陈锡玮为该论文的第一作者,邹懿教授为该论文的独立通讯作者。兰州大学董世辉教授和西南大学董照明教授为该工作提供了帮助。该项研究得到了国家重点研发计划合成生物学重点专项,重庆市杰出青年基金项目和西南大学2035先导计划项目的资助。
邹懿教授自2017年7月通过西南大学“聚贤工程”人才引进到药学院工作以来,以西南大学为唯一或第一完成单位,作为独立或最后通讯作者,已陆续在Nat Commun (2022a, 2022b),J Am Chem Soc (2022, 2020),ACS Catal (2021),Angew Chem Int Ed (2019),Acta Pharm Sin B (2019)和Org Lett (2021, 2019)等国际知名期刊上发表高水平研究成果,在真菌天然药物的酶学催化机理,合成生物制造与分子创新等领域取得了一系列重要进展。
撰稿人:邹懿 审核人:付志锋